Électronégativité : Définition, Echelles et variation dans le tableau périodique TD TP EXAMENS
Électronégativité : Définition, Echelles et variation dans le tableau périodique
Définition d’électronégativité
L’électronégativité d’un élément est la grandeur représentant la capacité d’un atome à attirer à lui les électrons de liaison dans une molécule. Les notions de potentiel d’ionisation et d’affinité électronique sont relatives à un atome seul.
Par contre, la notion d’électronégativité sera d’avantage utilisée par la suite car elle intervient quand l’atome se trouve associé à d’autres atomes. Il s’agit contrairement au potentiel d’ionisation et à l’affinité électronique qui sont des concepts physiquement bien définis, d’un concept qualitatif.
Elle intervient donc dans la formation des ions, mais aussi dans la compétition entre atomes liés pour attirer les électrons de la liaison. Cela sous-entend donc une notion de polarité.
Exemple : Dans une molécule, composée d’un atome A lié chimiquement à un atome B, l’atome le plus électronégatif portera un supplément de charge négative et l’autre un déficit égal. La liaison est alors dite polarisée, et résulte d’une probabilité de présence des électrons plus grande sur l ‘atome le plus électronégatif.
Les échelles d’électronégativité
L’électronégativité est une valeur définie empiriquement, dans une échelle numérique arbitraire. Il en existe plusieurs dont les plus connues sont l’échelle de Pauling et l’échelle de Mulliken.
Selon Mulliken, elle est égale à la moyenne arithmétique de l’énergie d’ionisation et de l’affinité électronique.
La définition de Pauling, encore utilisée aujourd’hui comme référence, est basée sur la valeur expérimentale des énergies de liaison et est comprise entre 0,7 et 4,0.
Bien que les méthodes utilisées soient différentes, les classements auxquels elles conduisent sont sensiblement identiques avec des valeurs numériquement voisines et respectant toutes la même tendance dans le tableau périodique.
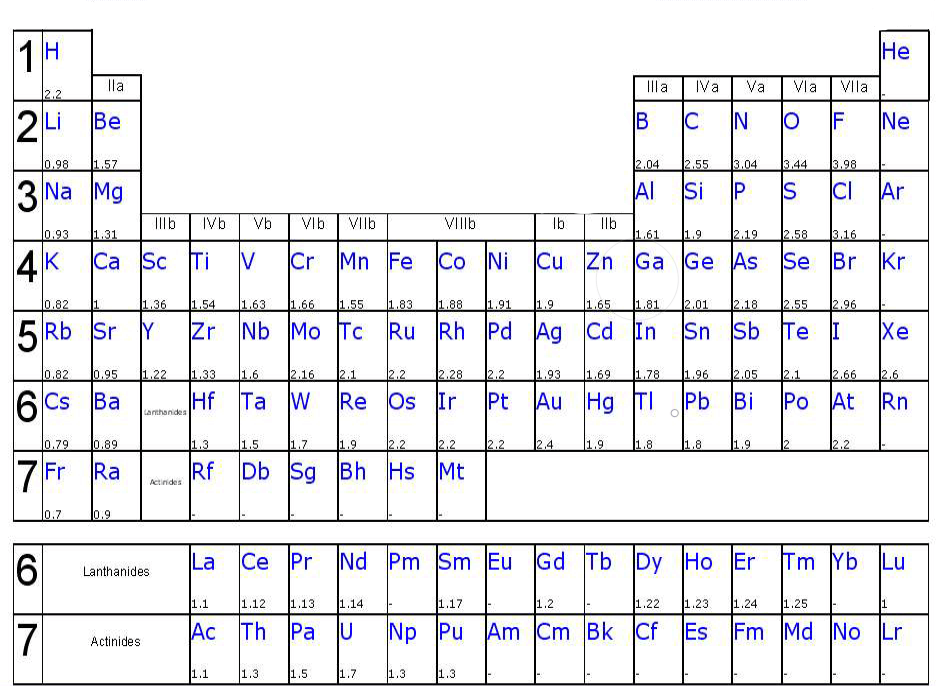
Variation de l’électronégativité dans le tableau périodique :
L’électronégativité augmente avec Z dans une période avec quelques exceptions pour les éléments de transition. Elle diminue dans un même groupe lorsque Z augmente.
Les éléments se situant en bas à gauche du tableau sont dits électropositifs (métaux) et cèdent facilement des électrons de valence lors de la formation d ‘une liaison chimique ; tandis que les éléments se situant en haut à droite sont dits électronégatifs (non métaux) et captent facilement des électrons de valence de leur partenaire lors de la formation d’une liaison chimique.
L’élément le plus électronégatif est le fluor.
Les éléments d’électronégativité intermédiaires, séparant les métaux des non-métaux, sont encore appelés semi-métaux.
Cette notion permet de prévoir le caractère de la liaison chimique que 2 éléments peuvent contracter :
- Si les électronégativités sont voisines, la liaison sera covalente,
- Si les électronégativités sont très différentes, la liaison prend un caractère ionique.