Liaison ionique cours et exercices corrigés TD TP EXAMENS
La liaison ionique résulte d’interactions électrostatiques entre ions de charges opposées.
Les ions les plus simples sont formés à partir d’un seul atome dont le numéro atomique Z est proche de celui d’un gaz rare. Dans ce cas, la perte ou le gain d’électrons permet d’atteindre la configuration électronique de ce gaz rare, caractérisée par une distribution sphérique des électrons très stable chimiquement. Prenons l’exemple des ions sodium et chlorure, Na+ et Cl-. La configuration des atomes neutres est, d’après la classification périodique, Na : 1s2 2s2 2p6 3s et Cl : 1s2 2s2 2p6 3s2 3p5. Les ions ont les configurations Na+ : 1s2 2s2 2p6 et Cl- : 1s2 2s2 2p6 3s2 3p6, qui sont respectivement celles du néon et de l’argon.
Dans un composé à liaisons purement ioniques, la symétrie sphérique de la distribution électronique de chaque ion est préservée. Les électrons restent localisés sur les ions et ne sont pas partagés comme c’est le cas dans une liaison covalente.
La liaison ionique n’est pas directionnelle par nature. La structure des composés ioniques correspond à une configuration des ions pour laquelle l’énergie d’interaction électrostatique est minimale. Ces composés prennent généralement la forme de grands réseaux cristallins dans lesquels chaque ion est entouré d’ions de charge opposée.
A l’instar des liaisons covalentes, les liaisons ioniques sont des liaisons fortes : le gain en énergie des électrons est de l’ordre de 5 eV par paire liée.
I- Exemples de structures basées sur des liaisons ioniques
Les liaisons purement ioniques peuvent être observées dans les composés halogénures alcalins, liant les éléments des première et avant-dernière colonnes du tableau périodique.
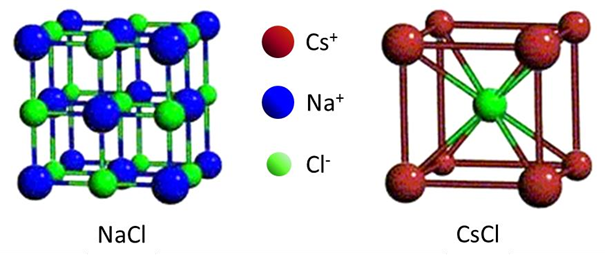
Les structures types de ces composés sont les structures NaCl et CsCl.
La maille cubique de NaCl contient (8 × 1/8 + 6 × 1/2) = 4 cations Na+, répartis aux sommets et au centre des faces. Le réseau formé par les anions Cl- est identique et décalé du réseau cationique par une translation de vecteur (1/2 0 0). Les cations comme les anions se trouvent en coordinence octaédrique : on compte six premiers voisins équidistants, formant une bipyramide à base carrée.
La maille cubique de CsCl contient seulement (8 × 1/8 + 1) = 2 ions. Les cations occupent les sommets de la maille tandis que l’anion occupe son centre. On peut remarquer que les réseaux formés par les cations et les anions sont à nouveau identiques, mais sont cette fois décalés par la translation (1/2 1/2 1/2). La coordinence des cations et des anions est égale à 8.
II- Étude expérimentale : réaction entre le sodium et le dichlore
Dans un tube à essai à trou latéral, un petit morceau de sodium est chauffé dans la flamme du brûleur Bunsen. Ensuite, le tube contenant le sodium enflammé est introduit dans un récipient rempli de dichlore.

Il y a une réaction vive entre le sodium et le dichlore qui s’accompagne d’un fort dégagement de chaleur et d’une émission de lumière jaune éblouissante.

Comme produit de la réaction des deux réactifs dangereux, on obtient un sel blanc non toxique : le chlorure de sodium (NaCl), qui est utilisé comme sel de cuisine.

II-1. Interprétation
Lors de la réaction chimique, il y a un changement au niveau du cortège électronique des atomes de sodium et de chlore : ils acquièrent la configuration électronique de l’argonide le plus proche dans le T.P.E. qui comporte un octet électronique sur la couche de valence.
II-2. Formation d’ions
Analysons de plus près la configuration électronique des réactifs de la réaction précédente :
a- Configuration électronique des atomes de sodium et de chlore (avant la réaction)
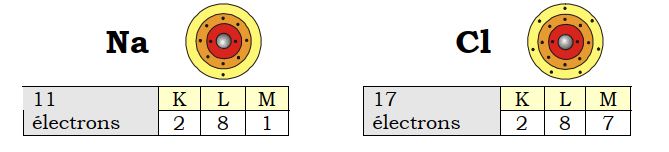
Le néon (Ne ; 10 électrons) est le gaz rare dont la configuration électronique est la plus proche de celle de Na (11 électrons).
L’argon (Ar ; 18 électrons) est le gaz rare dont la configuration électronique est la plus proche de celle de Cl (17 électrons).

Pour acquérir la configuration électronique de ces gaz rares, tous les atomes de sodium (Na) doivent perdre un électron, tandis que tous les atomes de chlore (Cl)doivent en accepter un.
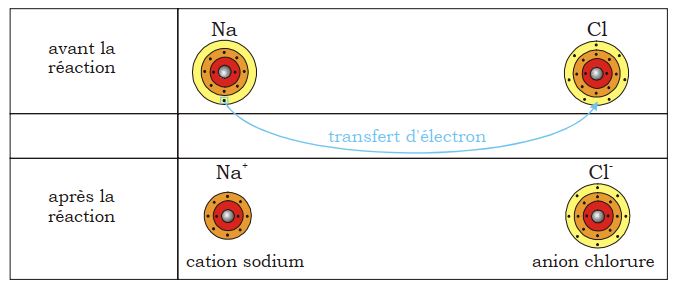
b- Configuration électronique des ions sodium et chlorure (après la réaction)

En perdant un électron, la couche M du sodium disparaît et l’avant-dernière couche devient dernière couche ; elle présente un octet électronique.
Analysons la charge des deux particules après cette transformation :

c- Équations ioniques

- Un atome chargé électriquement est appelé ion.
- Des ions chargés positivement (p.ex. Na+) sont appelés cations.
- Des ions chargés négativement (p.ex. Cl–) sont appelés anions.
II-3. Tableau récapitulatif
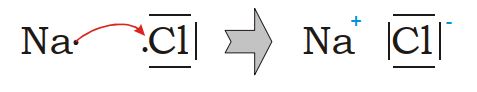
II-4. Écriture de la réaction à l’aide des symboles de Lewis
II-5. Réseaux ioniques
Lors de la réaction entre le dichlore et le sodium, il y a formation de cations (chargés positivement) et d’anions (chargés négativement).
Deux charges de même signe se repoussent, deux charges de signe contraire s’attirent.
Par conséquent, les cations se repoussent entre eux, de même que les anions se repoussent entre eux. Les anions et les cations s’attirent mutuellement ; la force électrostatique responsable de cette attraction est à l’origine de la liaison ionique. À cause des forces d’attraction et de répulsion entre les ions, il se forme un réseau tridimensionnel qu’on appelle réseau ionique. Le nombre d’ions dans un réseau ionique est extrêmement élevé.
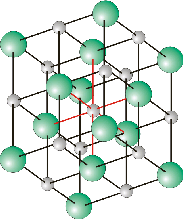
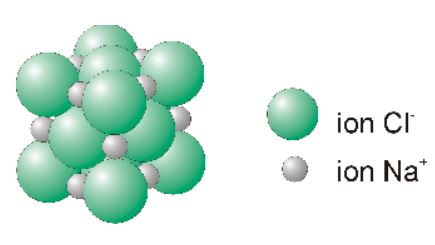
Des composés, qui (comme le chlorure de sodium) sont constitués de cations métalliques et d’anions non-métalliques assemblés dans un réseau ionique, sont appelés sels.
II-6. Formules chimiques
D’une part, un atome de chlore peut accepter autant d’électrons qu’un atome de sodium peut en céder (à savoir un seul).
D’autre part, le réseau ionique du chlorure de sodium est constitué du même nombre d’ions chlorure que d’ions sodium. Le réseau ionique est donc globalement neutre.
Dans le réseau ionique de NaCl, nombre de cations Na+ = nombre d’anions Cl Comme le réseau est constitué d’un très grand nombre d’ions, la formule chimique correspondante ne peut rendre compte que du rapport entre les deux types d’ions. La formule chimique du chlorure de sodium s’écrit donc :
NaCl
Ou Na+Cl– si on veut rendre compte de la charge des ions.
Pour plus de détails télécharger les documents ci-dessous:
Liens de téléchargement des cours sur Liaison ionique
Cours Liaison ionique N°1
Cours Liaison ionique N°2
Cours Liaison ionique N°3
Liens de téléchargement des exercices corrigés sur Liaison ionique
Exercices corrigés Liaison ionique